不含激素的银屑病外用药 Tapinarof(本维莫德)全方位解析
📌 一、银屑病:被忽视的慢性炎症难题
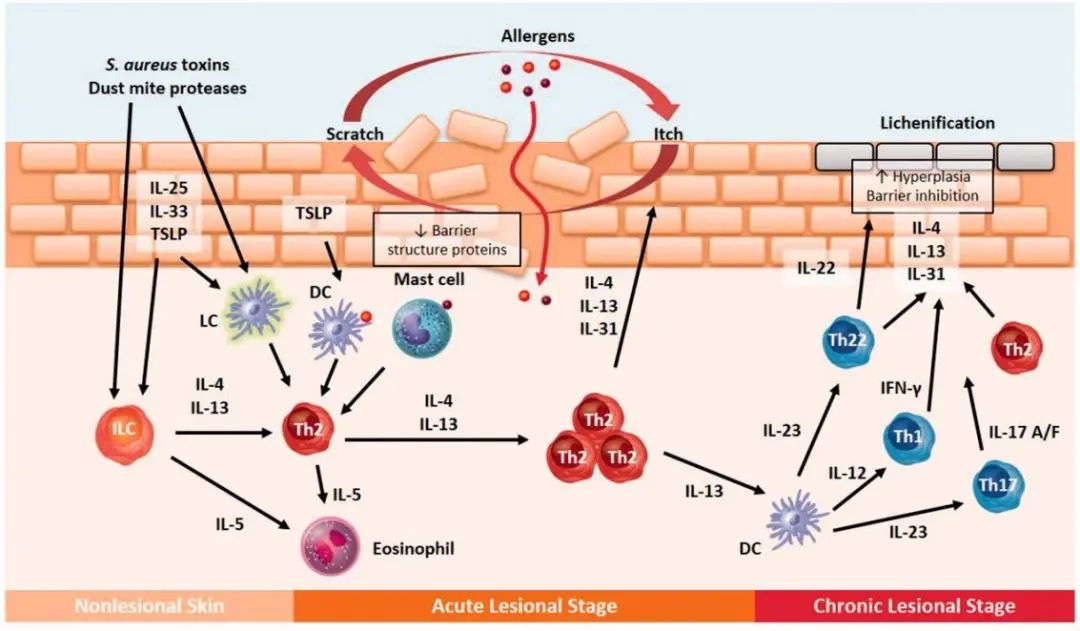
🌍 1.1 流行病学特征与疾病负担 银屑病俗称牛皮癣,全球患病率约1%-3%,呈显著纬度相关性(北方高于南方)。中国1984年首次全国流调显示总发病率为0.123%(中国皮肤性病学杂志,1985),2010年六省市调查升至0.47%(中华皮肤科杂志,2010)。典型表现为角质细胞异常增殖与免疫失调,约30%患者可能发展为银屑病关节炎(PsA)。
📊 1.2 疾病分型与临床特征
慢性斑块型(80-90%):边界清晰的红斑伴银白鳞屑,好发于头皮、肘膝
点滴型:突发小鳞屑斑,常继发链球菌感染
红皮病型(<3%):全身弥漫性潮红伴系统性症状
脓疱型:无菌性脓疱伴发热,掌跖多见(2021年国际银屑病理事会诊疗指南)
⚡ 二、Tapinarof 研发历程:中国原研的突破性进展
🔬 2.1 创新机制:AhR激烈剂的革命性发现 Tapinarof(本维莫德)是全球首个治疗性芳香烃受体(AhR)调节剂。AhR通路通过调控 IL-17/IL-23 等炎症因子,抑制表皮增生并修复皮肤屏障(J Invest Dermatol, 2022)。非激素特性突破传统治疗局限,实现疗效与安全性平衡。
⏳ 2.2 曲折上市:20年磨一剑
2007年:陈庚辉团队启动临床申报
2019年5月:NMPA批准上市,"十一五"重大专项成果
2022年5月:FDA批准Dermavant公司VTAMA®乳膏(NDA 215272)
2024年12月: (新泽西州泽西市) Organon公司宣布,美国食品药品监督管理局 (FDA) 已批准 VTAMA® (tapinarof) 本维莫德乳膏(1%),用于成人和 2 岁及以上儿童患者特应性皮炎 (AD) 的局部治疗。里程碑意义:我国首个先于欧美获批的FIC药物,打破皮肤科领域外资垄断

📊 三、临床数据:长程疗效与持续缓解优势
📐 3.1 III期试验核心成果(PSOARING系列)
(NEJM Evidence, 2022)
3.2 开放标签扩展试验(PSOARING 3)
52周持续用药显示:• 41.2%患者达到完全清除(PGA=0)• 停药后中位无复发期为122天(JAMA Dermatol, 2023)
3.3关于新适应症2岁及以上特应性皮炎(AD)的临床研究汇总
特应性皮炎 (AD),通常称为湿疹,是最常见的炎症性皮肤病之一,仅在美国就有超过 2600 万人受其影响,全球有 10% 的成年人受其影响。特应性皮炎最常发生在儿童身上,全球有 20% 的儿童受其影响。该病会导致皮肤发痒、发红、肿胀和开裂,通常发生在手臂褶皱处、膝盖后部、手、脸和颈部。瘙痒是特应性皮炎患者特别烦人的症状,并且往往会在夜间恶化,影响睡眠并导致疲劳,这会导致儿童在学校注意力不集中。由于疾病的可见性和不适感,特应性皮炎患者还可能经历社交和情感困扰。
【1】在 ADORING 关键研究中,1% VTAMA 乳膏在年仅 2 岁的中度至重度 AD 患者中证明,与载体相比,在第 8 周获得明显 (0) 或几乎明显 (1) 评分且较基线至少改善 2 级的患者比例在经验证的研究者整体 AD 评估 (vIGA-AD) 中分别为 45.4% 和 13.9%;在 ADORING 2 中分别为 46.4% 和 18.0%(P 值均<0.0001)。在所有次要终点方面,接受 VTAMA 乳膏治疗的患者与接受载体治疗的患者之间的差异具有统计学意义,包括第 8 周时湿疹面积和严重程度指数 (EASI) 评分较基线改善至少 75% (EASI75),以及第 8 周时患者报告的峰值瘙痒数值评定量表 (PP-NRS) 较基线改善≥4 分(年龄≥12 岁)。最常见的不良反应(发生率≥1%)是上呼吸道感染(12%)、毛孔周围出现红色凸起肿块(毛囊炎)(9%)、下呼吸道感染(5%)、头痛(4%)、哮喘(2%)、呕吐(2%)、耳部感染(2%)、四肢疼痛(2%)和胃部(腹部)疼痛(1%)。
【2】ADORING 3 是一项为期 48 周的开放标签 LTE 研究,其招募了来自 ADORING 1、ADORING 2(一项为期 4 周的最大用量药代动力学试验)的合格患者,以及直接招募者,这些患者均为 2-17 岁、患有轻度、中度或重度 AD(vIGA-AD 评分分别为 2、3 或 4)且不符合关键研究纳入标准的未使用过 VTAMA 乳膏的患者。
【3】在 ADORING 3 中,对患者 (N=728) 进行了长达 48 周的随访,其安全性和有效性终点包括实现完全疾病清除 (vIGA-AD=0) 和实现皮肤清洁或几乎清洁 (vIGA-AD=0 或 1)。进入研究时有任何疾病活动 (vIGA-AD≥1) 的患者使用 VTAMA 乳膏治疗,1% 直至实现完全疾病清除 (vIGA-AD=0) 或完成研究。对于进入 ADORING 3 时已实现或已实现完全疾病清除 (vIGA-AD=0) 并停止使用 VTAMA 乳膏治疗的 378 名患者,第一个无治疗 (缓解) 间隔的平均持续时间约为连续 80 天。AD 恢复到轻度或以上 (vIGA-AD≥2) 的患者重新使用 VTAMA 乳膏治疗,直至再次实现完全疾病清除或完成研究。长期使用的安全性与第 8 周观察到的安全性通常一致。
四、真实世界反馈:医患双视角评估
4.1 患者体验调研(n=599)
• 85.8%:便于日常疾病管理• 81.7%:优于既往外用药有效性• 79.9%:体验优于传统激素制剂
4.2 典型病例分析
美国银屑病论坛用户分享:"涂抹后无油腻感,3周内肘部斑块变平,但第2周出现毛囊炎,调整用量后缓解。"(National Psoriasis Foundation Forum, 2023)
4.3 用药选择
很多银屑病患者家庭并不富裕,这种动辄大几千的药物对他们总有点可望而不可即,所以从这个药物一开始上市就有患者问有没有仿版的,但是子弹终究要飞一会,经过四五年的研究,终于是出来了。有时候想好好的生活真的有点奢侈,所以有啥别有病,没啥别没钱。

五、规范用药指南(译自FDA说明书)
5.1 处方信息速查
【Vtama (Tapinarof)适应症】 Vtama(Tapinarof)乳膏是一种芳烃受体激动剂,适用于成人斑块型银屑病的局部治疗。
【Vtama (Tapinarof) 推荐剂量和给药方法】 1.推荐剂量每天一次,在病变部位涂上薄薄的一层Vtama。2.用药注意事项使用乳膏后洗手,除非Vtama霜是用于治疗手部的病变。Vtama乳膏不适合口服、眼科或阴道内使用。
【Vtama(Tapinarof)不良反应】 Vtama乳膏最常见的副作用包括:1.毛孔周围出现红色突起(毛囊炎)2.鼻子和喉咙疼痛或肿胀(鼻咽炎)3.皮疹或刺激,包括瘙痒和发红、脱皮、灼烧或刺痛4.头痛5.瘙痒6.流感
【Vtama(Tapinarof)在特殊人群中使用】
妊娠关于孕妇使用Vtama乳膏的可用数据不足以评估药物相关的重大出生缺陷、流产或其他不利的母亲或胎儿结局的风险。在动物生殖研究中,在器官形成期对怀孕大鼠和兔子皮下注射Tapinarof,剂量分别为人类最大推荐剂量(MRHD)的268倍和16倍,均未产生明显的不良影响。2. 哺乳期没有关于母乳中是否存在Tapinarof或Tapinarof对母乳喂养的婴儿或泌乳量的影响的数据。怀孕雌性大鼠皮下注射Tapinarof后,在其后代体内检测到Tapinarof,这表明Tapinarof转移到了哺乳期大鼠的乳汁中。当一种药物存在于动物乳汁中时,该药物也可能存在于人乳中。母乳喂养的发育和健康益处应与母亲对Vtama乳霜的临床需求以及Vtama或潜在母体疾病对母乳喂养婴儿的任何潜在不利影响一起考虑。3.儿童用药尚未确定Vtama乳膏对18岁以下银屑病儿童受试者的安全性和有效性。4.老年患者用药在PSOARING 1或PSOARING 2临床试验中暴露于Vtama乳膏的683名受试者中,99名(14.5%)为65岁及以上,其中8名(1.2%)受试者为75岁及以上。在临床试验中,未观察到老年受试者和年轻受试者在疗效、安全性或耐受性方面存在总体差异。
如果本文对您有帮助,请给个关注并赞一下,【医有我伴】将持续分享优质内容
注:版权声明,本网站平台所有注明来源”医有我伴”的文字、图片和视频资料,版权均属于医有我伴网站所有,未经授权,任何媒体、网站或个人不得进行转载,否则将追究其法律责任。在取得书面授权转载时,须注明来源“医有我伴”,本平台所转载的文章目的是信息的传递,转载内容不代表本站立场。如有涉及请与我网站联系d
