今天!无机化学专家/欧洲科学院外籍院士领衔,HOF,再上Nature!
使用非侵入性超声,精确控制深部组织内的机械化学激活,对提高人们对基础生物医学科学的理解和彻底改变疾病治疗,具有深远的影响。
但迄今为止,理论驱动型机械响应材料体系的构建,仍面临关键瓶颈——如何建立具有明确超声激活机制的材料系统尚待突破。
在此,来自美国德州大学奥斯汀分校的陈邦林&王辉亮等研究者提出了使用多孔氢键有机框架(HOFs)作为聚焦超声(FUS)可编程触发药物激活的工具包的概念,通过按需切断超分子相互作用来控制脑深部的特定细胞事件。相关论文以题为“H-bonded organic frameworks as ultrasound-programmable delivery platform”于2025年02月05日发表在Nature上。

这种精准控制对多种治疗场景至关重要:包括神经活动的瞬时调控、慢性疼痛的缓释管理,以及疾病不同进展阶段的时序性给药。
以光遗传学为代表的尖端技术,已实现对特定细胞光敏蛋白的精密操控,不仅深化了脑科学认知,更为神经疾病的按需治疗带来曙光。
然而其深层组织应用受限于光子传输效率,非侵入式分子操控技术因此成为临床转化的重要突破口。
聚焦超声(FUS)技术,凭借毫米级空间精度与卓越安全性,为深层组织非侵入控制提供了独特解决方案。
超声触发相变微泡、纳米乳剂及超声敏感脂质体等创新系统已在机械力疗法和局部麻醉领域展现潜力。
最新研究更揭示了超声精准断裂机械敏感轮烷致动器(分子开关装置)或聚合物框架中弱键合位点的可行性,为分子级药物操控开辟新途径。
但现有体系普遍面临双重挑战:强键合结构需高功率超声驱动,响应时间长达数小时;更关键的是复杂拓扑结构导致断裂效率、框架分子构型与超声参数间的构效关系难以理论化建模。
尽管超声触发系统取得显著进展,其分子作用机制仍缺乏系统性理论阐释,可编程超声响应系统的开发仍任重道远。
多孔框架材料(金属/共价有机框架等)凭借高载药量与明确结构成为药物递送研究热点。
其中氢键有机框架(HOFs)作为新兴明星材料,通过有机分子构筑单元(OMBUs)间的氢键与π-π堆积自组装形成,兼具结构均一性与可编程优势。
相较于其他框架材料的强配位/共价键,HOFs的弱非共价相互作用使其更易实现FUS机械化学激活。
丰富多样的分子构筑库更赋予其组成与功能的深度可调性。
若能通过非侵入超声实现HOFs的精准设计与选择性激活,将开创深层组织(特别是脑深部)远程给药新纪元,为神经调控等精密治疗提供革命性工具。
针对这一科学挑战,本研究创新性提出"氢键有机框架(HOFs)超声编程"概念:利用聚焦超声(FUS)按需切断超分子相互作用,实现深部脑区(可达9mm深度)特定细胞事件的精准调控。
通过建立机械化学断裂与超声力学的理论模型,首次可视化超声能量-材料响应-药物释放的级联过程,为可编程机械响应材料的理性设计提供指导原则。
实验验证中,将设计药物氯氮平N-氧化物(CNO)封装于优化HOF纳米晶体内,通过FUS门控释放在小鼠/大鼠腹侧被盖区(VTA)精准激活工程化G蛋白偶联受体,成功实现神经环路的秒级响应调控。
该工作不仅证实超声精准操控分子相互作用的可行性,更构建了具有时空分辨能力的超声编程HOFs平台,为深部组织无创分子诊疗开辟新范式。

图1 超声机械响应HOF的制备。

图2 超声波机械控制HOFs在水溶液中的解离。

图3 HOF-TATB纳米晶体的超声控制载物释放及其对神经活动的体外调节。
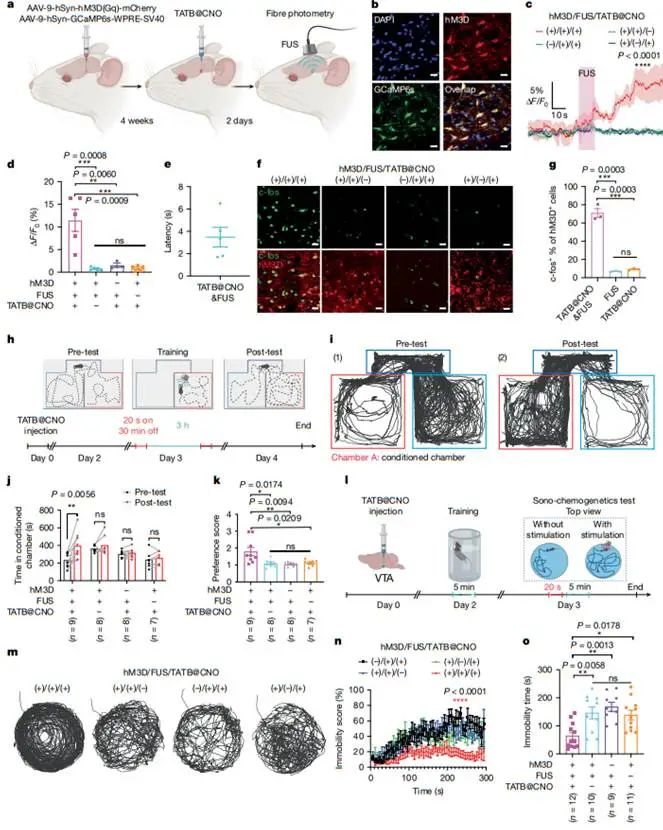
图4 小鼠体内声化学发生深部脑刺激。

图5 大鼠体内声化学发生深部脑刺激。
综上所述,本研究首创超声响应型HOFs分子工程体系:通过精准调控有机配体分子间作用单元化学结构,构建具有分子级可编程特性的超声激活平台。具体而言,HOFs通过离散有机分子单元间的弱氢键与π-π相互作用自组装形成三维多孔框架,这种独特的非共价组装机制赋予材料三重优势——水相环境稳定性可调、高载药效率及超声编程解离特性。
超声机械应力作为主要驱动力,可程序化剪切分子内弱键合网络实现可控机械化学激活。
通过系统调控有机配体骨架的氢键密度与芳香稠环数量,建立"结构-功能"关系理论模型,为分子水平精准设计HOFs构筑单元提供指导原则,实现在预设超声压力下的按需药物激活。
基于HOFs的智能响应特性,超声触发式时序可编程药物控释技术为无创神经调控开辟新纪元。
本研究通过优化HOFs纳米晶体的超声敏感性,成功实现小鼠与大鼠深部脑神经环路的秒级时空精准调控。
实验证明,超声-HOFs化学遗传耦合技术(UltraHOF-enabled sono-chemogenetics)兼具高时间分辨率(毫秒级)与长效调控优势(数小时级),同时保持微创特性。
该技术平台集成四大核心优势:高载药量(>30% w/w)、优异生物稳定性(72小时保持率>95%)、低免疫原性(血清补体激活<5%)及独特超声可编程性。
除化学遗传调控外,UltraHOFs技术还可拓展至多类型分子释放,通过设计不同激活阈值与时空分辨率,实现深部组织细胞事件的精准无创操控。
这项突破性研究为深组织分子机器人编程提供新范式,有望推动无创精准医疗向分子级操控时代迈进。
作者简介
陈邦林,德克萨斯大学圣安东尼奥分校化学系教授,无机化学专家,欧洲科学院外籍院士。1985年本科毕业于浙江大学化学系,1988年硕士毕业于无机化学专业,现任德克萨斯大学圣安东尼奥分校(University of Texas at San Antonio)化学系杰出讲座教授和该校杰出科学家学院成员。长期从事新型多孔材料的设计及其在气体吸附分离、荧光传感和催化等领域的研究,取得了一系列开创性的研究成果,为该领域的发展做出了杰出贡献,在国际无机化学领域有着重要的影响。
曾在Science(4), Nat. Mater(1), Nat. Energy(1), J. Am. Chem. Soc.(25), Angew. Chem. Int. Ed.(15), Adv. Mater.(13),Nat. Commun.(7),Chem. Rev.(1), Chem. Soc. Rev.(3), Acc. Chem. Res.(3)等顶级学术期刊发表有重要影响论文300余篇及16项专利(转让专利1项),被引用40000余次。
2018年获得洪堡研究奖(Humboldt Research Award),2016年获德克萨斯大学圣安东尼奥专利发明奖,2017年获得美国科学促进会会士(AAAS Fellow). 2011年名列汤姆森路透集团发布的2000-2010年全球顶尖一百化学家名人堂榜单第十五名。2014至2018年连续五年列入高被引科学家(化学)。
参考文献Wang, W., Shi, Y., Chai, W. et al. H-bonded organic frameworks as ultrasound-programmable delivery platform.Nature(2025). https://doi.org/10.1038/s41586-024-08401-0
原文链接:https://www.nature.com/articles/s41586-024-08401-0
https://baike.baidu.com/item/%E9%99%88%E9%82%A6%E6%9E%97/5580075
