危急~IVDR过渡期最短仅剩2个多月, 制造商该为CE行动了!
健康
03-03
阅读:0
评论:0
一、IVDR大限将至,制造商CE办证时间紧迫!
· 建立符合IVDR的质量体系仅剩2个多月,建议尽快取得ISO13485体系证书!
· D类IVD器械过渡期仅剩2个多月,D类CE办证时间至少24个月,应尽快启动办证!
· C类IVD器械过渡期仅剩不到15个月,C类CE办证平均周期为18个月,建议立即启动办证!
· 部分公告机构将IVDR技术文档作为签约的前提条件。因此,制造商准备IVDR技术文档是当务之急!

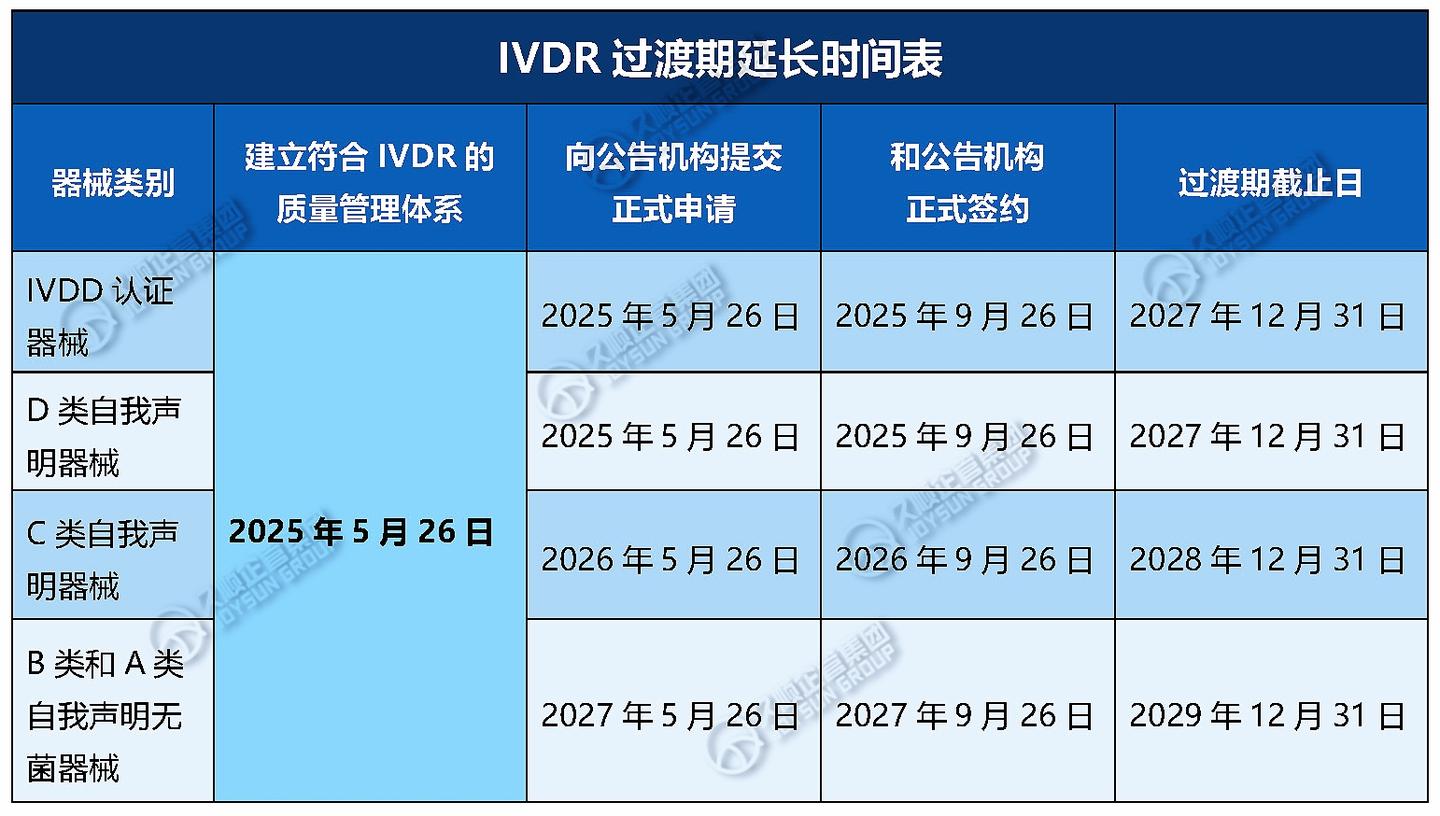
1. 首次延期
IVDD下属于Others而在IVDR属于B/C/D类, 获得IVDD CE注册后,根据延期政策IVD遗留器械以下过渡期截止日:
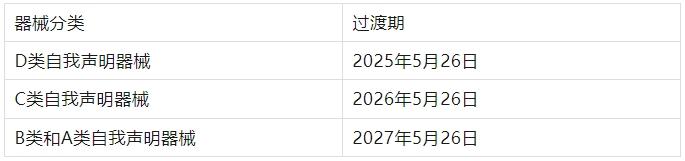
2. 再次延期
IVDD下属于Others而在IVDR属于B/C/D类, 获得IVDD CE注册后,取得NB机构的延期信函,根据延期政策可持续使用直至IVD遗留器械以下过渡期截止日:

需满足以下条件:
a.应继续符合指令98/79/EC;
b.器械设计和预期用途无重大变化;
c.不对患者/使用者或他人健康或安全,或保护公众健康等造成不可接受的风险;
d.2025年5月26日之前,制造商已升级质量管理体系,已符合EN ISO 13485和IVDR适用条款要求;
e.制造商已向公告机构提交正式申请或签署认证合同对产品进行合格评定,不迟于以下时间:

